PENGERTIAN KIMIA DAN STRUKTUR ATOM
Haiii Everyone 👋
Kali ini aku mau membahas dan mengingatkan kalian semuanya apa itu ilmu kimia? apa saja sih hukum hukum dasar kimia? kenapa sih bisa disebut atom? dan masih banyak lagi. yukk kita memahaminya bersama↴
ILMU KIMIA adalah ilmu yang mempelajari tentang materi meliputi struktur materi,susunan materi,sifat materi, perubahan materi dan energi yang menyertai perubahan materi.
Kali ini aku mau membahas dan mengingatkan kalian semuanya apa itu ilmu kimia? apa saja sih hukum hukum dasar kimia? kenapa sih bisa disebut atom? dan masih banyak lagi. yukk kita memahaminya bersama↴
ILMU KIMIA adalah ilmu yang mempelajari tentang materi meliputi struktur materi,susunan materi,sifat materi, perubahan materi dan energi yang menyertai perubahan materi.
MATERI adalah segala sesuatu yang menempati ruang dan
memiliki massa. Materi dapat berupa benda padat, cair, maupun gas.
ZAT adalah
materi yang memiliki susunan dan
sifat-sifat yang tertentu.
-KLASIFIKASI MATERI-
*ZAT TUNGGAL adalah materi yang mempunyai
sifat dan komposisi sama di seluruh bagiannya. Zat tunggal terdiri dari unsur
dan senyawa.
*CAMPURAN adalah materi yang terbentuk dari gabungan dua zat
tunggal atau lebih dengan komposisi yang bervariasi. Sifat dan karakteristik
campuran tergantung dari sifat zat tunggal penyusunnya.
HUKUM-HUKUM DASAR KIMIA
1. Hukum Kekekalan Massa (
Lavoisier) : Dalam setiap reaksi kimia,jumlah massa sebelum dan
sesudah reaksi selalu sama.
2.
Hukum Proporsi Tetap (Proust) : Dalam suatu
senyawa kimia,proporsi berdasar massa dari unsur unsur penyusunnya adalah
tetap,tidak bergantung pada asal usul senyawa tersebut atau cara pembuatannya.
STRUKTUR ATOM
ATOM pertama kali ditemukan oleh DEMOCRITUS . ATOM berasal dari kata ATOMOS yaitu TIDAK DAPAT
DI POTONG (BATAS KOMPONEN TERAKHIR).
STRUKTUR ATOM merupakan satuan
terkecil dalam materi baik itu berupa benda cair, padat, dan gas. Atom yang ada
menjadi bahan dasar pembentuk materi-materi yang ada sampai kepada bentuk yang
dapat kita rasakan. Seperti air, kayu, handphone, dan bentuk-bentuk
materi yang kasat mata misalnya gas, angin.
Dalam pembagiannya struktur atom terdiri atas 3 inti materi yang
memiliki fungsi dan tugasnya tersendiri. Yaitu proton, elektron, dan neutron.
Proton dan Neutron berada dalam inti
atom. Sedangkan, elektron berputar mengelilingi
inti atom berupa proton dan neutron.
Proton merupakan struktur atom yang bermuatan
positif (+). Neutron merupakan struktur atum yang bermuatan netral. Dan elektron
merupakan struktur atom yang bermuatan negatif (-).
1.
Penemuan
Elektron
Penemu elektron adalah J.J
Thomson melalui percobaan sinar katode.
Muatan elektron ditemukan oleh
Robert Milikan melalui percobaan tetesan halus minyak.
Sifat-sifat Sinar katode:
- merambat tegak lurus dari permukaan katode menuju anode
- merupakan radiasi partikel, terbukti dapat memutar kincir
- bermuatan listrik negatif sehingga dibelokkan ke kutub positif
- dapat memendarkan berbagai jenis zat, termasuk gelas
2.
Penemuan
Proton
Penemu proton adalah Eugene
Goldstein melalui percobaan sinar katode yang telah dimodifikasi,
yaitu memberi lubang (saluran) di tengah katode.
Sifat-sifat Sinar Anode (sinar
terusan):
- merupakan radiasi partikel (dapat memutar kincir)
- dalam medan listrik/magnet dibelokkan ke kutub negatif, jadi merupakan radiasi bermuatan positif
- partikel sinar terusan tergantung pada jenis gas dalam tabung
3.
Penemuan
Neutron
Penemu neutron adalah James
Chadwick melalui percobaan dengan menembaki atom Berilium dengan sinar
alfa. Neutron tidak bermuatan.
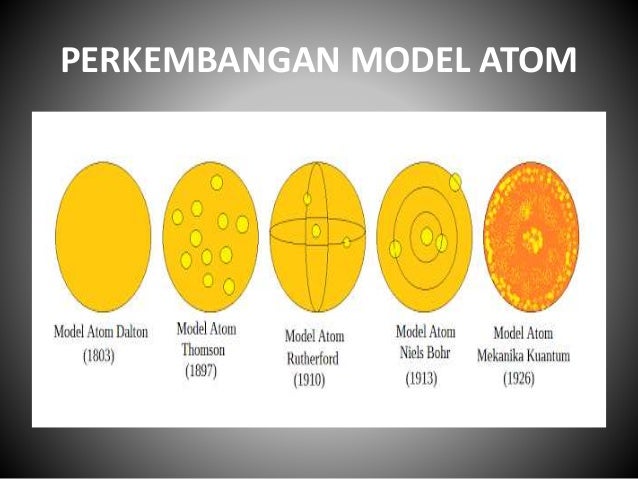
*Perkembangan Teori Atom*
Model Atom Dalton
- Atom merupakan partikel terkecil suatu materi yang berbentuk bola.
- Atom tidak dapat diciptakan dan dimusnahkan
- Atom dari unsur yang sama mempunyai sifat yang sama, atom dari unsur yang berbeda mempunyai sifat yang berbeda pula
- Pada reaksi kimia terjadi penggabungan atau pemisahan atom-atom.
Model atom Dalton (1805) Atom sebagai bola pejal
Kelemahan:
- Tidak dapat menjelaskan sifat listrik materi
- Tidak dapat menjelaskan daya gabung unsur-unsur. Misalnya mengapa satu atom oksigen dapat mengikat dua atom hidrogen membentuk air.
Model Atom J. J. Thomson
Setelah menemukan elektron, Thomson menggambarkan
bahwa atom merupakan bola pejal bermuatan positif dan di dalamnya bertebaran
elektron-elektron yang bermuatan negatif bagaikan kismis dalam roti kismis,
secara keseluruhan atom bersifat netral.
Model Atom Thomson (1897) Atom bermuatan positif ditaburi
elektron bermuatan negatif
Kelemahan :Tidak dapat menerangkan dinamika reaksi kimia yang terjadi antar atom.
Model Atom Ernest Rutherford
Setelah menemukan inti atom, Rutherford mengemukakan model atom yang menyatakan bahwa atom terdiri atas inti atom yang bermuatan positif dan dikelilingi oleh elektron-elektron yang bermuatan negatif.
Model Atom Rutherford (1911). Inti atom bermuatan positif
yang dikelilingi elektron bermuatan negative
Model Atom Niels Bohr
Ditahun
1913, seorang pakar fisikawan asal Denmark dengan nama Niels Bohr menyatakan
bahwasanya teori atom dari Rutherford dapat untuk disempurnakan kembali menjadi
teori atom yang lebih baik. Dimana, Niels Bohr dengan percobaan yang dilakukan
menggunakan teori kuantum dari Planck.
Berdasarkan
hasil penelitian yang dilakukannya. Bohr pun mengemukakan teori yang di
milikinya yang menyebutkan bahwa elektron yang bermuatan negatif berputar
mengengelilingi inti atom yang bermuatan atom positif pada jalur lintasanya
tersendiri. Dan setiap lintasan elektron yang memiliki orbitnya tersendiri
memiliki kekuatannya elektronnya tersendiri.
Model Atom Modern (Mekanika kuantum)
Teori Atom Mekanika Kuantum didasarkan pada
dualisme sifat elektron yaitu sebagai gelombang dan sebagai partikel.



■ Menurut de Broglie,
cahaya dapat berperilaku sebagai materi dan berperilaku sebagai
gelombang (dikenal dengan istilah dualisme gelombang partikel).
■ Menurut Heisenberg,
tidak mungkin menentukan kecepatan dan posisi elektron secara
bersamaan, tetapi yang dapat ditentukan hanyalah kebolehjadian menemukan
elektron pada jarak tertentu dari inti.

Erwin Schrodinger mengajukan teori yang disebut
teori atom mekanika kuantum ”Kedudukan elektron dalam atom tidak dapat
ditentukan dengan pasti yang dapat ditentukan adalah kemungkinan menemukan elektron sebagai fungsi jarak dari inti atom”.

♡♡♡♡♡♡♡MAAF BILA ADA KEKURANGAN ,KARENA KESEMPURNAAN HANYA MILIK ALLAH SWT♡♡♡♡♡♡♡
^^SEMOGA MEMPERMUDAH UNTUK BELAJAR YA^^
sumber :
https://www.slideshare.net/kevyn52/00kimia
https://enjiner.com/struktur-atom/
https://bisakimia.com/2017/08/05/ringkasan-materi-struktur-atom/
https://blogmipa-kimia.blogspot.com/2018/05/model-atom-mekanika-kuantum-modern.html
https://blogmipa-kimia.blogspot.com/2018/05/model-atom-mekanika-kuantum-modern.html