HAI EVERYONE🙋
A.Klasifikasi Ikatan
Ikatan
kimia adalah ikatan yang terbentuk antar atom atau antar molekul dengan cara :
- Atom yang satu melepaskan elektron, sedangakan atom yang lain menerima elektron (serah terima elektron)
- Penggunaan bersama pasangan elektron yang berasal dari masing-masing atom yang berikatan
- Penggunaan bersama pasangan elektron yang berasal dari salah satu atom yang berikatan
Tujuan
pembentukan ikatan kimia adalah guna terjadi pencapaian kestabilan suatu unsur.
Kestabilan unsur terjadi apabila suatu unsur mengikuti aturan oktet. Aturan
Oktet adalah kecenderungan unsur-unsur untuk menjadikan konfigurasi
elektronnnya sama seperti gas mulia. Unsur gas mulia (Gol VIIIA) mempunyai
elektron valensi sebanyak 8 (oktet) atau 2 (duplet, hanya unsur Helium).

1. Ikatan Ion
Ikatan
ion (elektrovalen), adalah ikatan yang terbentuk akibat adanya perpindahan
(serah-terima) elektron dari satu unsur ke unsur yang lain. Kedua ikatan
tersebut berikatan dengan adanya gaya elektrostatis. Unsur yang cenderung
melepaskan elektron adala unsur logam sedangkan unsur yang cenderung menerima
elektron adalah unsur nonlogam.
“Ikatan yang terbentuk apabila unsur logam melepas elektron dan diikuti dengan unsur nonlogam yang menerima elektron”
Dengan
kata lain, satu memberi dan satu
menerima

2. Ikatan Kovalen
Ikatan
kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara
bersama oleh dua atom yang belikatan. Ikatan kovalen terjadi akibat
ketidakmampuan salah satu atom yang akan berikatan untuk melepaskan elektron,
yang dalam pembentukannya, masing-masing atom mempunyai orbital pada kulit
terluar yang berisi elektron tunggal. Dan kedua orbial tersebut saling
tumpang-tindih (overlap) sehingga sebuah pasangan elektron terbentuk, kemudian
dipakai secara bersama oleh kedua atom. Ikatan kovalen terbentuk oleh sesama unsur
non logam.
“ikatan yang terbentuk akibat adanya pemakaian elektrom bersama-sama antara unsur non logam”
Dengan
kata lain, sama-sama memberi dan
menerima

3. Ikatan Logam
Ikatan
logam adalah ikatan yang terbentuk akibat adanya gara tarik menarik yang
terjadi antara muatan pisitif dari ion-ion logam dengan muatan negatif dari
elektron-elektron yang bebas bergerak. Atom-atom logam dapat diibaratkan bola
ping-pong yang terjejal rapat satu sama lain. Atom logam mempunyai sedikit
elektron valensi, sehingga sangat mudah untuk dilepaskan dan membentuk ion
positif.
B. Faktor Geometri
1. Jari jari atomik dan ionik
a. Jari jari atom
Jari-jari atom adalah jarak dari inti atom ke batas awan elektronnya. Dengan kata lain, itu adalah jarak dari nukleus ke elektron terjauh yang dimiliki atom itu. Jari-jari atom dapat didefinisikan hanya untuk atom yang terisolasi dan netral.
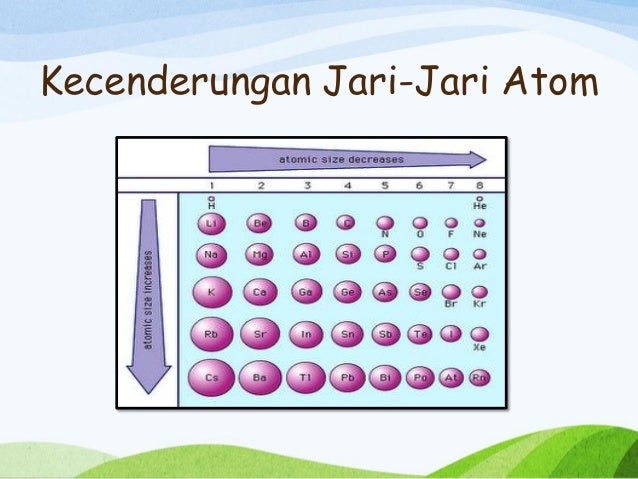
b. Jari jari ion
Jari-jari ion adalah jari-jari ion atom. Ion tidak bisa hidup sendiri. Jika ion bermuatan positif, ion ini akan bereaksi dengan ion bermuatan negatif (atau sebaliknya) dan menjadi senyawa netral stabil. Senyawa ini disebut senyawa ion karena terbuat dari komponen ion. Senyawa ion terdiri dari kation dan anion . Ukuran kation lebih kecil karena kation dibentuk dengan membuang satu atau lebih elektron dari atom. Anion besar karena memiliki elektron ekstra yang dipukul oleh nukleus, sehingga terjadi peningkatan jarak antara nukleus dan elektron terjauh dari awan elektron.

2. Entalpi Kisi
Ketika ion dalam keadaan gas bereaksi satu dengan yang lainnya membentuk senyawa kemudian melepaskan entalpi atau mengubah nilai entalpi, itulah disebut entalpi kisi. Sebagui contoh yakni pembentukan NACI yang biasanya melepaskan kalor ke lingkungan.
Na+(g)+Cl-(g)⇔NaCI(s)

3. Tetapan Madelung
Energi potensial Coulomb total antar ion dalam senyawa ionik yang terdiri atas ion A dan B adalah penjumlahan energi potensial Coulomb interaksi ion individual, Vab. Karena lokasi ion-ion dalam kisi kristal ditentukan oleh tipe struktur, potensial Coulomb total antar ion dihitung dengan menentukan jarak antar ion d. A adalah tetapan Madelung yang khas untuk tiap struktur kristal
4. Struktur Kristal Logam
Ikatan antar teras atom orbital atom yang terisi penuh elektron bersama sama inti atom yang dikelilingi oleh elektron elektron bebas
contoh :
- Body Centered Cubic (BCC)
- Face Centered Cubic (FCC)
- Hexagonal Closed Packed (HCP)

5. Kristal Ionik
Kristal ionik terbentuk karena adanya gaya tarik antara ion bermuatan positif dan negatif. Umumnya, kristal ionik memiliki titik leleh tinggi dan hantaran listrik yang rendah. Contoh dari kristal ionik adalah NaCl. Kristal ionik tidak memiliki arah khusus seperti kristal kovalen sehingga pada kristal NaCl misalnya, ion natrium akan berinteraksi dengan semua ion klorida dengan intensitas interaksi yang beragam dan ion klorida akan berinteraksi dengan seluruh ion natriumnya.
6. Aturan Jari jari
Anion membentuk koordinasi polihedral disekeliling kation. jari jari rX adalah separuh sisi polihedral dan jarak kation di pusat polihedral ke sudut polihedral merupakan jumlah jari jari kation dan anion rx+rm
C. Faktor Elektronik
1. Muatan Inti Efektif
Karena muatan positif inti biasanya sedikit banyak dilawan oleh muatan negatif elektron dalam (dibawah elektron valensi), muatan inti yang dirasakan oleh elektron valensi suatu atom dengan nomor atom Z akan lebih kecil dari muatan inti, Ze. Penurunan ini diungkapkan dengan konstanta perisai σ, dan muatan inti netto disebut dengan muatan inti efektif,
Zeff. Zeff = Z – σ
Muatan inti efektif bervariasi mengikuti variasi orbital dan jarak dari inti.2. Energi Ionisasi
Energi ionisasi adalah energi minimum yang diperlukan untuk melepaskan satu elektron dari suatu atom dalam keadaan dasar (berada dalam wujud gas). Energi ionisasi sangat dipengaruhi oleh jari-jari atom. Jika jari-jarinya pendek maka energi ionisasinya besar, dan sebaliknya jika jari-jarinya panjang, maka energi ionisasinya kecil.
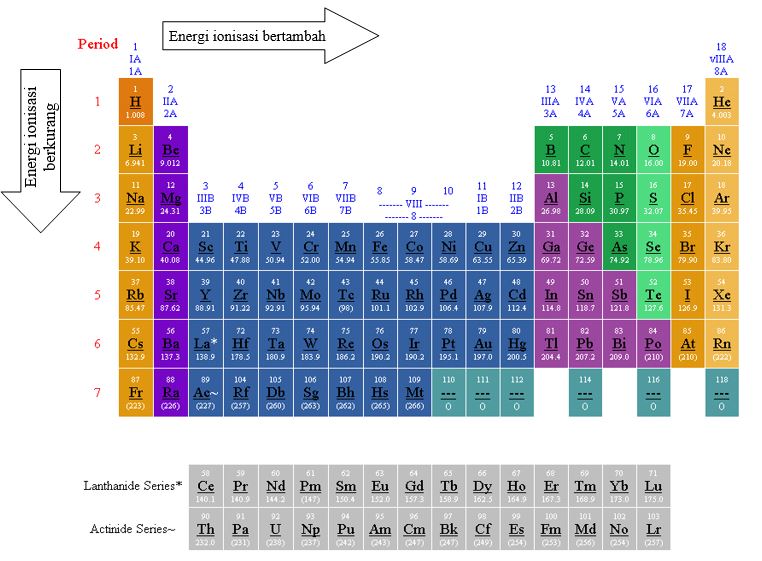
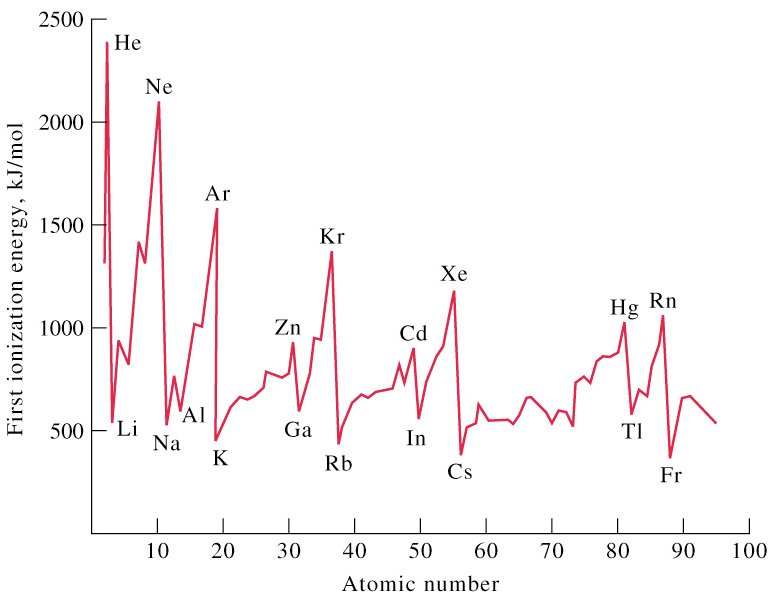
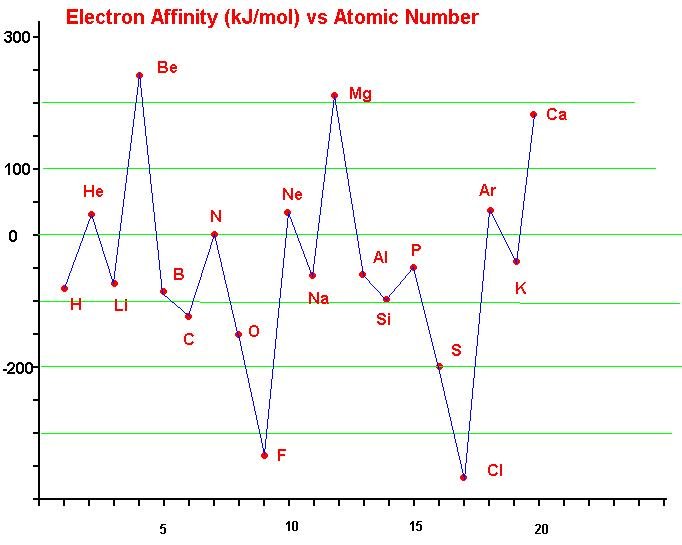
3. Afinitas Elektron
Setiap atom memiliki sifat dapat melepas dan menerima elektron. Ketika melepaskan elektron, atom-atom dalam periodik unsur tidak memerlukan energi. Namun sebaliknya, ketika mereka menerima elektron mereka memerlukan energi. Energi inilah yang disebut sebagai afinitas elektron. Lebih singkatnya, afinitas elektron adalah energi yang dibebaskan suatu atom untuk menerima satu atau lebih elektron.
4. Ke-elektronegatifan
a. Pauling pertama kali mengajukan[2] konsep elektronegativitas pada tahun 1932 sebagai penjelasan dari fenomena lebih kuatnya ikatan kovalen antar dua atom berbeda (A–B) dari yang diperkirakan dengan mengambil kekuatan rata-rata ikatan A–A dan B–B. Menurut teori ikatan valensi, "stabilisasi tambahan" dari ikatan heteronuklir ini disebabkan oleh kontribusi bentuk kanonis ion kepada ikatan.
Perbedaan elektronegativitas antara dua atom A dan B dapat dihitung dengan:
b. Mulliken mengajukan bahwa purata aritmetik dari energi ionisasi pertama dan afinitas elektron haruslah adalah sebuah perhitungan dari kecenderungan sebuah atom menarik elektron-elektron.[6][7] Karena definisi ini tidak bergantung pada skala relatif sembarang, ia juga disebut sebagai elektronegativitas relatif,[8] dengan satuan kilojoule per mol atau elektronvolt.
Namun biasanya kita menggunakan transformasi linear untuk melakukan transformasi nilai absolut tersebut menjadi nilai yang lebih mirip dengan nilai Pauling. Untuk energi inonisasi dan afinitas elektron dalam elektronvolt,[9]
c. Allred dan Rochow beranggapan[10] bahwa elektronegativitas haruslah berhubungan dengan muatan sebuah elektron pada "permukaan" sebuah atom: semakin tinggi muatan per satuan luas permukaan atom, semakin besar kecenderungan atom tersebut untuk menarik elektron-elektron. Muatan inti efektif, Z* yang terdapat pada elektron valensi dapat diperkirakan dengan menggunakan kaidah Slater. Sedangkan luas permukaan atom pada sebuah molekul dapat dihitung dengan asumsi luas ini proposional dengan kuadrat jari-jari kovalen (rcov). rcov memiliki satuan ångström,
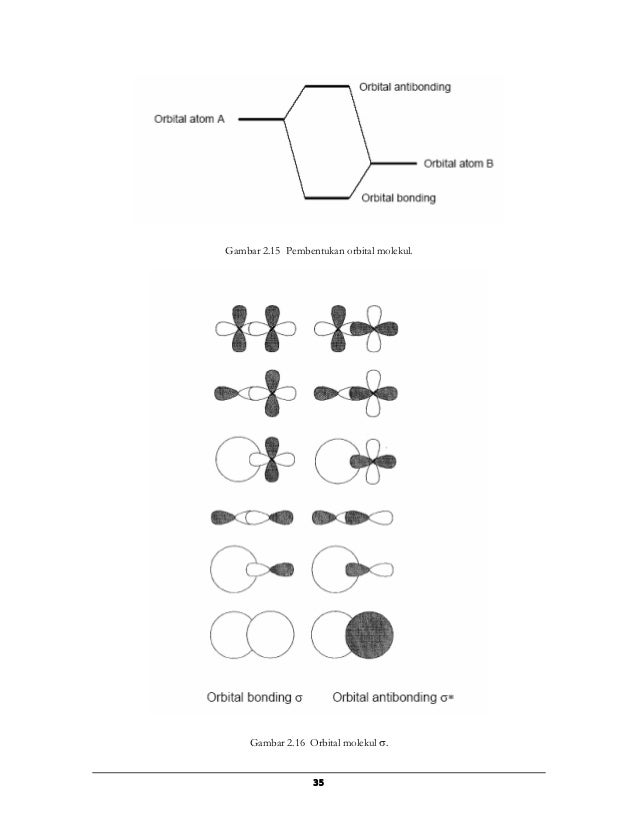
Dalam pembentukan molekul, orbital atom bertumpang tindih menghasilkan orbital molekul yakni fungsi gelombang elektron dalam molekul. Jumlah orbital molekul adalah jumlah atom dan orbital molekul ini diklasifikasikan menjadi orbital molekul ikatan, non-ikatan, atau antiikatan sesuai dengan besarnya partisipasi orbital itu dalam ikatan antar atom. Kondisi pembentukan orbital molekul ikatan adalah sebagai berikut.
Syarat pembentukan orbital molekul ikatan:
(1) Cuping orbital atom penyusunnya cocok untuk tumpang tindih.
(2) Tanda positif atau negatif cuping yang bertumpang tindih sama.
(3) Tingkat energi orbital-orbital atomnya dekat.
(2) Tanda positif atau negatif cuping yang bertumpang tindih sama.
(3) Tingkat energi orbital-orbital atomnya dekat.

Kesimpulan :

Agak membingungkan yaa?? coba berlatih terus pasti bisa kokk😆😆😆 jangan pernah bosan datang ke blog aku yaa
^^SEMOGA MEMBANTU ^^
❤❤❤❤❤❤MAAF BILA ADA KEKURANGAN, KARENA KESEMPURNAAN HANYA MILIK ALLAH SWT❤❤❤❤❤❤
Sumber :

![{\displaystyle \chi _{\rm {A}}-\chi _{\rm {B}}=({\rm {eV}})^{-1/2}{\sqrt {E_{\rm {d}}({\rm {AB}})-[E_{\rm {d}}({\rm {AA}})+E_{\rm {d}}({\rm {BB}})]/2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a052f62dbffe5724cddbfe997ea4b35c06767cff)






Sangat bermanfaat terimakasih
BalasHapusSangat membantu
BalasHapusBermanfaat. Terimakasih
BalasHapussangat bermanfaat
BalasHapusbagus dan sangat bermanfaat kak
BalasHapusThanks, sangat membantu dan bermanfaat:)
BalasHapusBaguss
BalasHapusMantaap warbiyasaah
BalasHapusMntpp
BalasHapuspembahasannya bagus :)
BalasHapusMantal kak
BalasHapusSangat memberi wawasan tentang ilmu kimia, good job
BalasHapusbaguss
BalasHapusGood
BalasHapusNice
BalasHapusSangat bermanfaat kak, mkasih
BalasHapusNice kk
BalasHapusSangat bermanfaat. terima kasih :)
BalasHapusNicee blognya kakkk
BalasHapusBagus kak
BalasHapusMudah dimengerti
BalasHapusSangat bermanfaat dan mudah dimengerti
BalasHapusMakasih kak sangat bermanfaat!
BalasHapus